Los diagramas de equilibrio son una herramienta de gran utilidad en el campo de ingeniería ya que el estudio de las transformaciones de fases sirve como base para relacionar las propiedades de los materiales con la microestructura y por ende la estructura cristalina.
Existen diferentes tipo de diagramas de equilibrio como por ejemplo: diagramas monarios, binarios y ternarios. Sin embargo, para este caso solo nos enfocaremos a los diagramas binarios que están formado por dos componentes. Estos diagramas sirven como guía para encontrar la microestructura o transformaciones en estado sólido que existen para una composición y a una temperatura determinada.
Términos importantes:
- Fase: es la porción de una estructura químicamente homogénea.
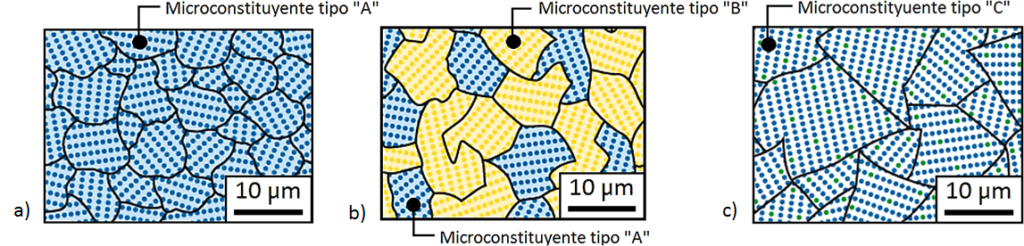
- Constituyente o microconstituyente estructural: es el elemento de una estructura susceptible de ser observado a través de microscopia óptica. A continuación, se ejemplifica la microestructura de 3 materiales diferentes:
- Diagramas de fases binarios: De forma general, se clasifican como diagramas binarios de solubilidad total y diagramas de solubilidad parcial. Los diagramas de fase muestran, como su nombre lo indica, las fases o microconstituyentes estables en función de dos variables, normalmente composición y temperatura. Por lo tanto, nos indicara las fases de equilibrio cuando se somete una aleación a enfriamientos relativamente lentos. Por otro lado, si se realizan enfriamientos rápidos (temple), es necesario recurrir a otra serie de diagramas en donde aparecen fases de “no equilibrio”, es decir, fases metaestables como por ejemplo: diagramas TTT (Tiempo, Temperatura, Transformación) o CCT (Transformaciones de Enfriamiento Continuo, por sus siglas en ingles).
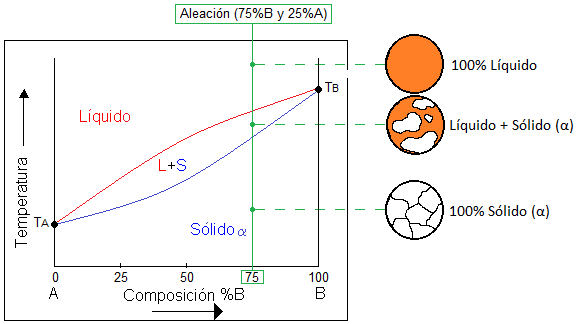
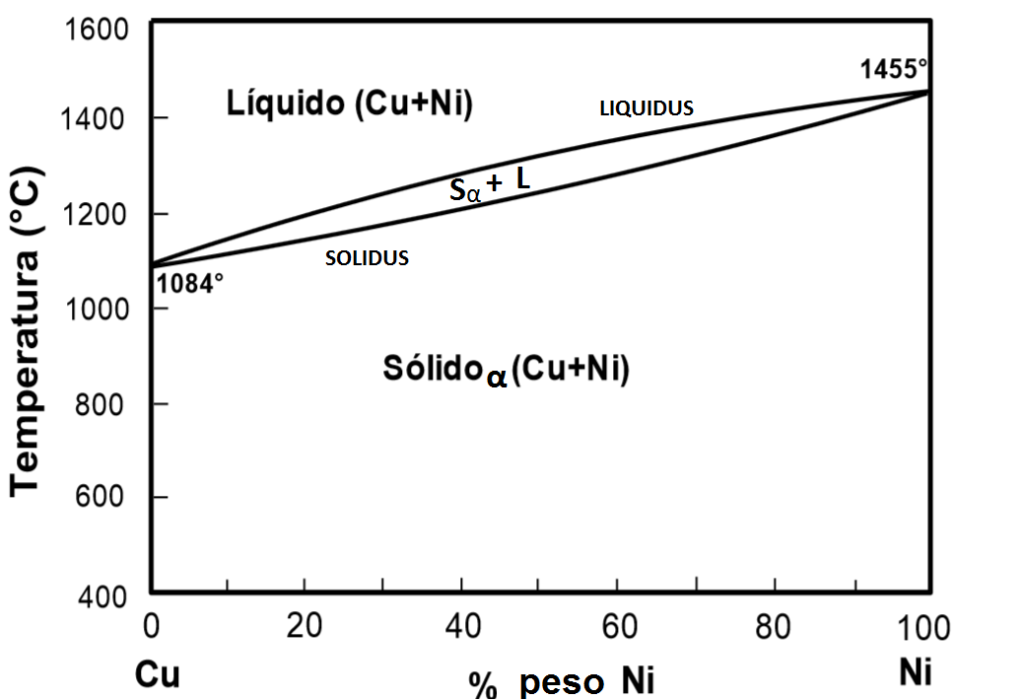
Diagrama de fase binario de solubilidad total (isomorfo):
Es un sistema binario que está compuesto por dos componentes, para ejemplificarlo los nombraremos como “A” y “B”. La palabra Isomorfo o solubilidad total en el diagrama de fases indica que los dos componentes son solubles entre si tanto en estado líquido y sólido y siempre van a presentar una sola fase sin importar la concentración de la mezcla. Los componentes más importantes en el diagrama son:
- Línea de líquidus: Indica que la zona que este por arriba de esta línea el sistema está en estado líquido.
- Línea de sólidus: Indica que la zona que este por debajo de esa línea el sistema está en estado sólido, nombrada fase (α).
- Zona bifásica: Entre líquidus y sólidus coexisten las fases sólida y líquida (α+L).
- Puntos de fusión/solidificación: Los puntos TA y TB indican la temperatura de fusión/solidificación de cada elemento en estado puro.
- Composición: La composición de la mezcla entre A y B está representada en porcentaje en peso y muestra en la parte inferior del diagrama. Generalmente está indicada de forma ascendente de izquierda a derecha del componente B.
Condiciones para una solubilidad ilimitada:
Para que un sistema de aleación de aleación tenga solubilidad solida ilimitada debe satisfacer ciertas condiciones denominadas como las reglas de Hume-Rothery; que son los siguientes:
- Factor tamaño: Los átomos o los iones deben tener tamaño semejante, con una diferencia de radio atómico no mayor al 15%, para minimizar la deformación de la red, es decir, minimizar, a nivel atómico, las desviaciones causadas en las distancias interatómicas.
- Estructura cristalina: Los materiales deben tener la misma estructura cristalina; de lo contrario, se llegará a un punto en el que se presenta una transición de una fase a otra con una estructura distinta.
- Valencia: Los iones deben tener más o menos la misma valencia; de no ser así, la diferencia de electrones de valencia impulsa la formación de compuestos, no de soluciones.
- Electronegatividad: Los átomos deben tener mas o menos electronegatividad. La electronegatividad es la afinidad hacia los electrones. Si las electronegatividades son apreciablemente distintas, se formaran compuestos, como cuando el sodio y cloro se combinan formando un compuesto de cloruro de sodio.
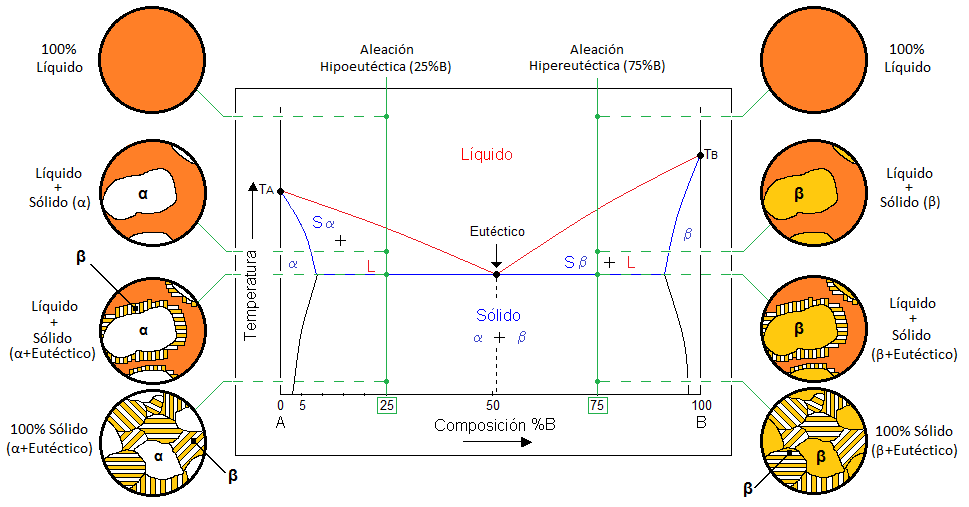
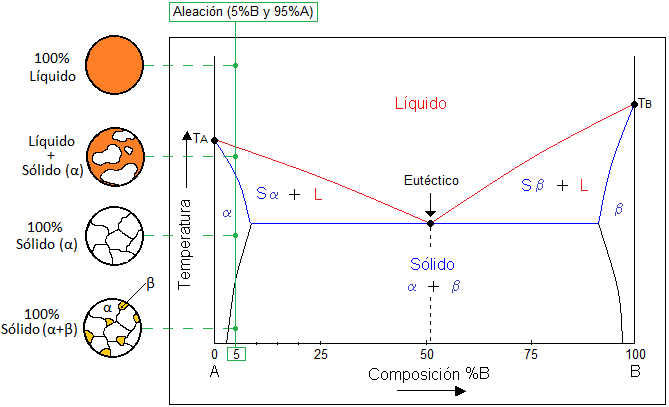
Diagramas de fase binario de solubilidad parcial:
Al igual que el diagrama binario de solubilidad total, el sistema está compuesto por dos componentes “A” y “B”. Sin embargo, se le denomina parcial porque la mezcla solo es soluble a ciertas condiciones de composición y temperatura. Los componentes más importantes en este tipo de diagramas son los siguientes:
- Línea de líquidus: Indica que la zona que este por arriba de esta línea el sistema está en estado líquido.
- Línea de sólidus: Indica que la zona que este por debajo de esa línea el sistema está en estado sólido, nombrada fase (α).
- Línea de solvus: Indica las temperaturas para las cuales una solución sólida (α ó β) entre A y B deja de ser soluble para transformarse en dos soluciones sólidas (α+β) de distinta composición en A y B.
- Zonas bifásicas (α+L), (β +L): Entre líquidus y sólidus existen dos zonas donde coexisten las fases sólida y líquida.
- Punto Eutéctico: Se refiere a la temperatura con el punto de fusión/solidificación más bajo posible en el diagrama de fases. Esto quiere decir que durante la solidificación de una aleación, los constituyentes (α+β) solidifican simultáneamente a partir del líquido (1Líquido↔2 Sólidos).
- Puntos de fusión/solidificación: Los puntos TA y TB indican la temperatura de fusión/solidificación de cada elemento en estado puro.
- Composición: La composición de la mezcla entre A y B está representada en porcentaje en peso y muestra en la parte inferior del diagrama. Generalmente está indicada de forma ascendente de izquierda a derecha del componente B.

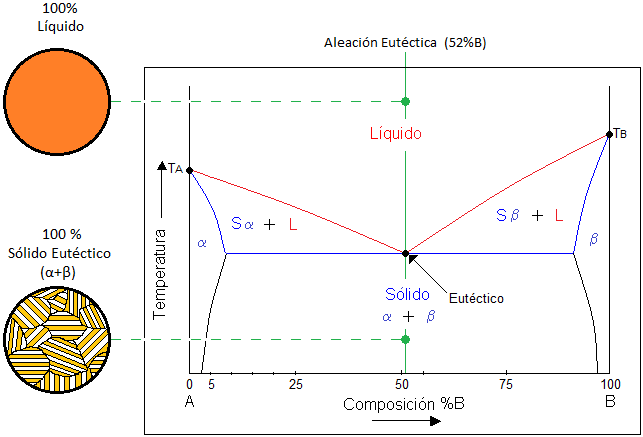
Aleaciones eutécticas
El termino eutéctico proviene del griego eutectos, que significa fácilmente fusible. En realidad una aleación que se encuentra exactamente en el eutéctico indica que tiene el menor punto de fusión en el diagrama de fases y que sus dos componentes α y β solidifican simultáneamente a la misma temperatura. Cuando los átomos se distribuyen durante la solidificación eutéctica, se desarrolla una microestructura característica. Para las aleaciones eutécticas las fases solidas α y β crecen en un arreglo en forma de láminas.
Aleaciones hipoeutécticas e hipereutécticas.
Una aleación hipoeutéctica es aquella cuya composición estará del lado izquierdo de la línea de enlace que define la reacción eutéctica. Cuando se enfría una aleación hipoeutéctica el líquido comienza a solidificar justo en la linea de líquidus, produciendo solido α. Sin embargo, la solidificación termina a través de la reacción eutéctica a temperatura constante. Esta secuencia de solidificación sucede para composiciones en las cuales la linea vertical correspondiente a la composición original de la aleación cruza en líquidus y el eutéctico. De la misma forma pero la composición de una aleación se encuentra en el lado izquierdo de la reacción eutéctica se define como aleación hipoeutéctica.